Communication à caractère promotionnel
Ce communiqué ne peut être distribué directement ou indirectement
aux Etats-Unis d’Amérique, au Canada, en Australie, au Japon ou en Afrique du Sud.
MaaT Pharma lance son introduction en bourse sur le marché réglementé d’Euronext Paris
et annonce sa fourchette indicative de prix
Lyon, France – le 15 octobre 2021 – 7h30
- Augmentation de capital d’un nombre de 2 333 333 actions ordinaires nouvelles (correspondant, à titre indicatif, à un montant d’environ 35,0 M€[1]) pouvant être porté à maximum de 3 085 831 actions ordinaires nouvelles (correspondant, à titre indicatif, à un montant d’environ 46,3 M€ en cas d’exercice intégral de la clause d’extension et de l’option de surallocation[2])
- Engagements de souscription reçus à hauteur de 17,9 M€ de ses actionnaires historiques et actuels
- Fourchette indicative de prix de l’offre : entre 13,50 € et 16,50 € par action
- Clôture de l’Offre à Prix Ouvert : le 2 novembre 2021 (à 17h aux guichets et à 20h par Internet)
- Clôture du Placement Global : le 3 novembre 2021 à 12h00 (heure de Paris)
- Eligible aux PEA et PEA-PME [3] et au dispositif 150-0 B ter du CGI (remploi de plus-value de cession).
[1]Sur la base du point médian de la fourchette indicative de prix.
[2] Sur la base du point médian de la fourchette indicative de prix.
[3] Ces dispositifs sont conditionnels et dans la limite des plafonds disponibles. Les personnes intéressées sont invitées à se rapprocher de leur conseiller financier.
MaaT Pharma S.A.(MaaT Pharma ou la Société), société française de biotechnologies en stade clinique avancé, pionnière dans le développement de médicaments dans la restauration du microbiote [1] intestinal pour améliorer la survie des patients atteints de cancers, ) annonce le lancement de son introduction en Bourse en vue de l’admission aux négociations de ses actions sur le marché réglementé d’Euronext à Paris (code ISIN : FR0012634822- mnémonique : MAAT). L’Autorité des marchés financiers (AMF) a approuvé, le 14 octobre 2021, le Prospectus sous le numéro 21-445, composé du Document d’enregistrement, approuvé le 1er octobre 2021 sous le numéro I.21-057, du supplément au document d’enregistrement approuvé par l’AMF en date du 14 octobre 2021 sous le numéro I.21-061, d’une Note d’Opération et d’un résumé du Prospectus (inclus dans la Note d’Opération).
Hervé Affagard, co-fondateur et Directeur Général de MaaT Pharma déclare :
« MaaT Pharma ambitionne de changer l’industrie pharmaceutique mondiale en développant des médicaments de nouvelle génération issus d’écosystèmes bactériens complets. Alors qu’aujourd’hui 25% de la population mondiale est atteinte d’une altération de son microbiote intestinal, nos données cliniques montrent que sa restauration pourrait jouer un rôle majeur dans l’amélioration des chances de survie des patients atteints de la maladie aiguë du greffon contre l’hôte (à la suite d’une greffe de moelle osseuse) et que cela pourrait également être le cas dans d’autres tumeurs liquides et solides. Notre projet d’introduction en bourse s’inscrit dans une période charnière de notre histoire, alors que les premières étapes clés ont été franchies avec l’obtention de résultats cliniques de Phase II prometteurs et le lancement d’une Phase III prévu avant la fin de l’année. J’espère que notre projet remportera l’adhésion de nouveaux actionnaires institutionnels et de particuliers pour nous accompagner et soutenir le déploiement de notre stratégie ambitieuse qui vise d’abord à répondre à des enjeux de santé publique majeurs pour le bénéfice de millions de patients. »
Une approche thérapeutique innovante par la modulation du microbiote intestinal pour améliorer la survie des patients atteints de tumeurs liquides et solides
Le microbiote intestinal est composé d’un ensemble de microorganismes (« écosystème ») riche et diversifié et contribue à maintenir une symbiose[2] entre l’hôte et ses milliards de microbes naturellement présents dans le corps humain. Cette symbiose est essentielle pour notre santé et influence différents systèmes physiologiques, en particulier notre système immunitaire (80% des cellules immunitaires résident dans l’intestin)[3] et notre métabolisme. Une symbiose à l’équilibre offre une protection grâce à une barrière intestinale plus forte et contribue à l’éducation et à la maturation du système immunitaire contre de potentiels pathogènes. Néanmoins, les modes de vies, l’alimentation ou encore l’usage de médicaments toxiques pour le microbiote peuvent amener une altération de cette relation. Ce phénomène de « dysbiose » qui s’illustre par une perte de diversité de nos microorganismes représente aussi un danger pour l’hôte car les bactéries sont susceptibles, par exemple, d’induire des réactions inflammatoires délétères ou de rendre suboptimal l’efficacité de certains traitements anticancers.
Afin de répondre à des besoins médicaux insatisfaits importants en oncologie, MaaT Pharma développe une approche thérapeutique écologique innovante, par la modulation du microbiote intestinal, en concevant des candidats médicaments à haute richesse et diversité microbiennes provenant de donneurs sains ou produits par co-fermentation, grâce à sa plateforme MET (‘Microbiome Ecosystem Therapy’).
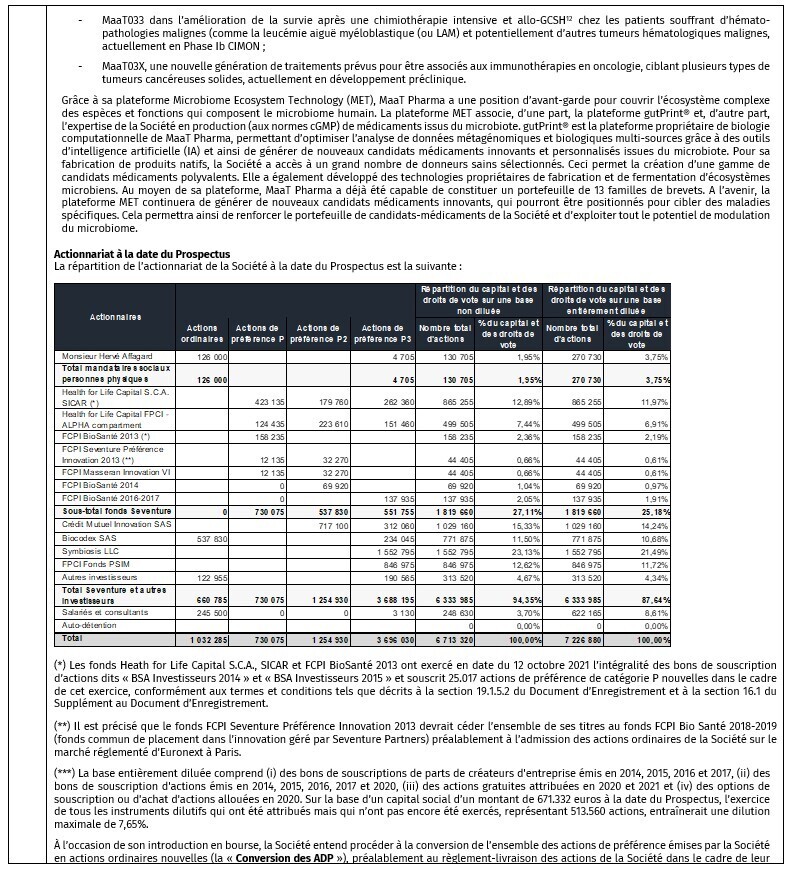
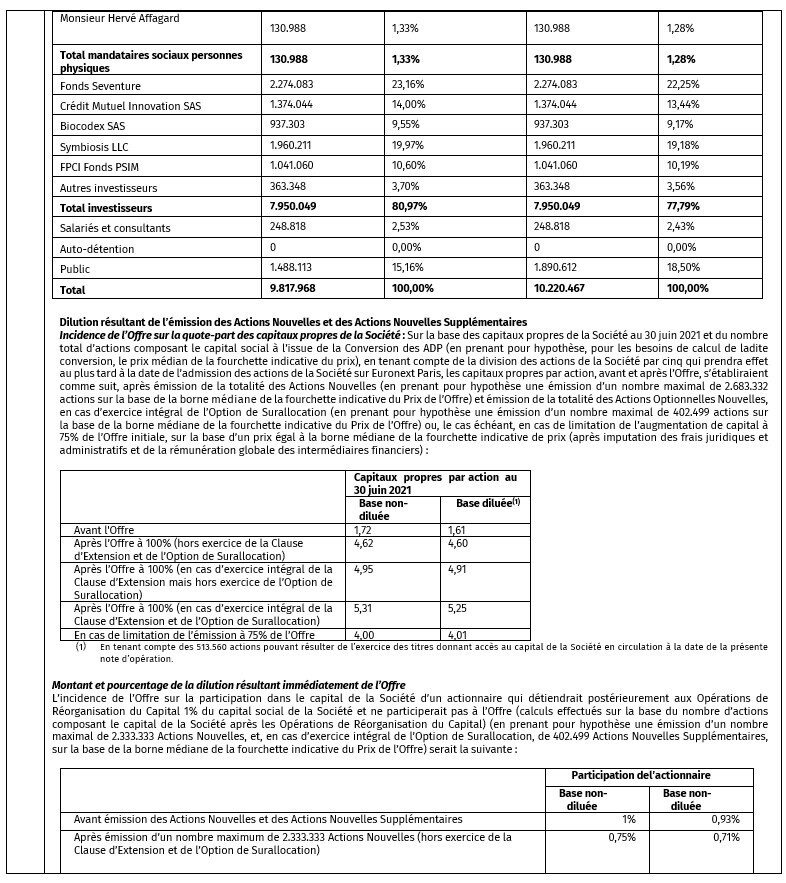
Les principaux candidats médicament de MaaT Pharma sont :
- MaaT013 pour le traitement de la maladie aiguë du greffon contre l’hôte (aGvH), prêt à entrer en Phase III dans l’UE[4] (demande d’essai clinique soumise) ; MaaT013 devrait également bientôt entrer en Phase II dans un essai de preuve de concept pour évaluer son impact sur l’amélioration de traitements en immuno-oncologie, dans le mélanome métastatique.
- MaaT033 dans l’amélioration de la survie après une allo-GCSH[5] chez les patients atteints de leucémie aiguë myéloblastique (LAM) et potentiellement d’autres tumeurs hématologiques malignes, est actuellement en Phase Ib.
- MaaT03X, une nouvelle génération de traitements prévus pour être associés aux immunothérapies en oncologie, ciblant plusieurs types de tumeurs cancéreuses solides, fait actuellement l’objet d’études précliniques.
[1] Le microbiote intestinal (aussi appelé « flore intestinale ») désigne l’ensemble des micro-organismes (bactéries, archées, levures, virus…) naturellement présents dans l’intestin. Il joue notamment un rôle important dans l’éducation et la modulation du système immunitaire et dans le métabolisme.
[1]Le microbiote intestinal (aussi appelé « flore intestinale ») désigne l’ensemble des micro-organismes (bactéries, archées, levures, virus…) naturellement présents dans l’intestin. Il joue notamment un rôle important dans l’éducation et la modulation du système immunitaire et dans le métabolisme.
[2] Symbiose : relation mutuellement bénéfique
[3] Castro G.A. & Charles J.A., Am. J. Physiol. 265 (Gastrointest. Liver Physiol. 28) : G599-G610, 1993.
[4] Ces dispositifs sont conditionnels et dans la limite des plafonds disponibles. Les personnes intéressées sont invitées à se rapprocher de leur conseiller financier.
[5] Allo-GCSH : greffe de cellules souches hématopoïétiques allogéniques.
Une stratégie ambitieuse de développement
Dans un marché à fort potentiel et offrant de multiples opportunités pour la Société, MaaT Pharma entend poursuivre une stratégie ambitieuse articulée autour de quatre grands axes :
- Concentrer son développement sur la modulation du microbiote en oncologie (tumeurs cancéreuses liquides et solides) qui présente des besoins médicaux insatisfaits importants, lui permettant de maximiser son expertise et de consolider sa position de pionnier dans l’environnement du microbiote tout en se différenciant de ses pairs ;
- Elargir progressivement son portefeuille de produits en développant de nouvelles thérapies innovantes issues du microbiote dans les domaines de l’hémato-oncologie et de l’immuno-oncologie en misant sur ses expertises internes et sa plateforme technologique propriétaire. La plateforme propriétaire MET de la Société permet d’utiliser les données cliniques déjà accumulées pour réduire significativement le temps de développement de nouveaux candidats médicaments et les risques associés. La combinaison de gutPrint® et d’un processus de fabrication innovants et exclusifs, aux normes cGMP, servent de pierre angulaire au renforcement et à l’élargissement du portefeuille de la Société ;
- Construire une société biopharmaceutique intégrée, qui puisse d’une part commercialiser à terme de façon indépendante ses produits les plus avancés, en raison de la centralisation des centres hospitaliers réalisant la procédure d’allo-GCSH, et d’autre part établir d’éventuels accords de collaboration avec un ou plusieurs partenaires pharmaceutiques de plus grande taille dans des indications plus larges, pour le développement et/ou la commercialisation de nouveaux candidats médicaments générés grâce à sa plateforme propriétaire MET ;
- Poursuivre une collaboration étroite avec les autorités réglementaires dans ce domaine pionnier pour soutenir le développement efficace de nouvelles thérapies. Depuis 2014, MaaT Pharma a reçu la validation de plusieurs essais cliniques par l’ANSM et d’autres agences européennes, et obtenu la désignation de médicament orphelin en 2018 pour MaaT013 par les autorités américaines (FDA) et européennes (EMA). Depuis 2018, MaaT013 fait notamment l’objet d’un programme d’accès compassionnel (ex-« ATU nominative ») dans l’aGvH, autorisé par l’ANSM.
Une introduction en bourse sur le marché réglementé d’Euronext Paris pour financer la croissance et les développements
L’introduction en bourse de MaaT Pharma vise à doter la Société de moyens financiers nécessaires pour mettre en œuvre sa stratégie de développement et accélérer sa croissance. Le produit net estimé de l’offre dans le cadre de cette opération (d’un montant d’environ 31,5 M€ pouvant être porté à environ 42,0 M€ en cas d’exercice intégral de la clause d’extension et de l’option de surallocation)[1] sur la base du point médian de la fourchette indicative de prix) permettra à MaaT Pharma de poursuivre les objectifs suivants :
- presque deux tiers à la réalisation de son programme clinique incluant la phase III de MaaT013, le lancement de la phase II/III de MaaT033 et les travaux préparatoires de la phase I/II de MaaT03x, incluant les dépenses courantes internes rattachées à ces activités ;
- plus d’un tiers pour le « scale-up » industriel de fabrication des produits MaaT013, MaaT033 et MaaT03x incluant des paiements forfaitaires au titre des travaux pour la construction de bâtiments modulaires pharmaceutiques, l’achat des équipements en propre aux procédés de la société et des dépenses courantes internes rattachées à ces activités.
La Société a reçu des engagements de souscription à hauteur de 17,9M€ de ses actionnaires historiques et actuels
La Société a reçu des engagements de souscription à hauteur d’environ 17,9 M€ (soit environ 51,2 % du montant de l’Offre initiale sur la base du point médian de la fourchette indicative de prix), à tout prix au sein de la fourchette indicative du prix de l’Offre, de la part de ses actionnaires historiques :
| Investisseurs | Engagements de souscription en numéraire |
| Seventure Partners (Health for Life Capital) | 4,9 millions d’euros |
| SymBiosis | 4,6 millions d’euros |
| Biocodex | 2,3 millions d’euros |
| Bpifrance | 2,5 millions d’euros |
| Crédit Mutuel Innovation | 3,0 millions d’euros |
| Skyviews Life Science Ltd | 0,4 million d’euros |
| Celeste Management SA | 0,3 million d’euros |
En outre, Eurekare, une société dédiée au financement de sociétés de biotechnologie dans les domaines du microbiote et de la biologie synthétique, s’est par ailleurs engagée à souscrire à l’Offre pour un montant d’environ 1,0 million d’euros.
Eligibilité de l’offre aux PEA et PEA-PME
MaaT Pharma annonce respecter les critères d’éligibilité au dispositif PEA-PME précisés par les dispositions des articles L. 221-32-2 et D.221-113-5 et suivants du Code monétaire et financier. En conséquence, les actions MaaT Pharma peuvent pleinement être intégrées au sein des plans d’épargne en actions (PEA) et des comptes PEA-PME, qui bénéficient des mêmes avantages fiscaux que le PEA classique.
Mise à disposition du Prospectus
Le document d’enregistrement de la Société approuvé par l’AMF en date du 1er octobre 2021 sous le numéro I.21-057, le supplément au document d’enregistrement approuvé par l’AMF en date du 14 octobre 2021 sous le numéro I.21-061, la note d’opération et le résumé du prospectus sont disponibles sans frais et sur simple demande auprès de MaaT Pharma et sur les sites Internet : www.amf-france.org et https://investir.maatpharma.com. L’approbation du Prospectus ne doit pas être considérée comme un avis favorable sur les valeurs mobilières offertes ou admises à la négociation sur le marché réglementé d’Euronext Paris.
Facteurs de risque
La Société attire l’attention du public sur les facteurs de risque décrits au chapitre 3 du document d’enregistrement approuvé par l’AMF et du chapitre 3 du supplément au document d’enregistrement approuvé par l’AMF ainsi qu’à la section 2 « Facteurs de risques de marché pouvant influer sensiblement sur les valeurs mobilières offertes » de la Note d’Opération. Les investisseurs potentiels sont invités à lire le Prospectus avant de prendre une décision d’investissement afin de pleinement comprendre les risques et avantages potentiels associés à la décision d’investir dans les valeurs mobilières de la Société. La survenance d’un ou plusieurs de ces risques peut avoir un effet négatif non-négligeable sur l’activité, les résultats, la situation financière et les perspectives de la Société, ainsi que sur la valeur des actions de celle-ci.
[1] Sur la base du point médian de la fourchette indicative de prix
Fonds de roulement net
La Société attire l’attention du public sur le fait que :
- la Société ne dispose pas d’un fonds de roulement net suffisant pour faire face à ses obligations et à ses besoins de trésorerie d’exploitation des douze prochains mois. La trésorerie disponible au 31 août 2021 (i.e., 15,3 millions d’euros) permettra à la Société de poursuivre ses activités jusqu’à la fin du premier trimestre 2022 (en tenant compte d’un versement à venir au titre d’une subvention d’un montant de 478.498 € (issu d’une subvention de 1.913.993 € de Bpifrance octroyée en juillet 2021) et des frais incompressibles inhérents au projet d’introduction en bourse à la charge de la Société même en cas de non-réalisation de l’opération, soit environ 1,1 million d’euros ;
- le montant supplémentaire nécessaire à la poursuite de son exploitation, dans le cadre de l’exécution du business plan de la Société tels que décrits au cours des douze mois suivant la date d’approbation du Prospectus par l’AMF est estimé à environ 15 millions d’euros d’avril 2022 à fin octobre 2022. Ce montant intègre le paiement (i) des dépenses opérationnelles liées à l’activité sur la période, (ii) des échéances de remboursement des emprunts et dettes financières pour un total de 0,7 million d’euros, (iii) des paiements forfaitaires au titre des travaux pour la construction de bâtiments modulaires pharmaceutiques, tels que défini dans une « term sheet » conclu avec Skyepharma le 30 septembre 2021, et l’achat des équipements propre aux procédés de la société pour un total de 3,0 millions d’euros ;
- ce montant de 15 millions d’euros sera financé par le produit net des souscriptions reçues dans le cadre de l’Offre, à hauteur de 31,5 million d’euros (sur la base d’une souscription à l’augmentation de capital à hauteur de 100%, avec un prix médian déduction faite des frais estimés liés à l’Offre), ce qui permettrait à la Société de financer la poursuite de ses activités jusqu’au 3ème trimestre 2023.
Dans le cas d’une offre souscrite à hauteur 75% et en retenant un prix en bas de la fourchette de 13,50€ par action, soit 20,6 millions d’euros (net des frais incompressibles inhérents au projet d’introduction en bourse), la Société procédera à certains arbitrages tels que décrits à la note 3.4 du Prospectus afin de poursuivre ses activités principales.
Intermédiaires financiers et conseils
Retrouvez toute l’information relative
au projet d’introduction en bourse de MaaT Pharma sur :
https://investir.maatpharma.com
PRINCIPALES MODALITES DE L’OPERATION
- CAPITAL SOCIAL AVANT L’OPÉRATION
Société anonyme à conseil d’administration, au capital de 671,332 euros divisé en 6, 713 320 actions de 0,10 € de nominal chacune.
- CARACTÉRISTIQUES DE L’ACTION
- Libellé : MAAT PHARMA
- Code mnémonique : MAAT
- Code ISIN : FR0012634822
- Marché de cotation : Euronext Paris
- Classification ICB : 20103010 – Biotechnology
- LEI : 969500CQQB6XUNW6CN97
- Eligible aux PEA et PEA-PME et au dispositif 150-0 B ter du CGI (remploi de plus-value de cession) [1]
- FOURCHETTE INDICATIVE DE PRIX
Entre 13,50 euros et 16,50 euros par action nouvelle telle que décidée par le conseil d’administration le 14 octobre 2021. Cette information est donnée à titre purement indicatif et ne préjuge en aucun cas du prix de l’offre qui pourra être fixé en dehors de cette fourchette indicative.
- TAILLE INITIALE DE L’OFFRE
La totalité des actions ordinaires existantes de la Société composant le capital social de la Société seront admises aux négociations. L’Offre s’effectuera par la mise sur le marché de 2,333 333 actions nouvelles à émettre (correspondant, à titre indicatif, à un montant de 35,0 millions d’euros, prime d’émission incluse[2]), pouvant être portées à un montant maximum de 2,683 332 actions nouvelles en cas d’exercice en totalité de la clause d’extension.
- OPTION DE SURALLOCATION
Afin de couvrir d’éventuelles surallocations, la Société consentira à Portzamparc (l’« Agent Stabilisateur ») au nom et pour le compte des coordinateurs globaux et teneurs de livre associés une option permettant l’acquisition d’un nombre d’actions représentant un maximum de 15% du nombre cumulé d’actions nouvelles susceptibles de résulter de l’exercice éventuel de la Clause d’Extension, soit un maximum de 402.499 actions cédées supplémentaires, permettant ainsi de faciliter les opérations de stabilisation (l’ « Option de Surallocation »).
Cette Option de Surallocation pourra être exercée, en tout ou partie, au prix de l’offre, en une seule fois à tout moment par l’Agent Stabilisateur, au nom et pour le compte des coordinateurs globaux et teneurs de livre associés, à compter de la fixation du prix de l’offre et jusqu’au 30e jour calendaire suivant le début des négociations des actions de la Société sur Euronext Paris, soit selon le calendrier indicatif, à compter du 8 novembre 2021 jusqu’au 8 décembre 2021 inclus et réaliser des opérations de stabilisation à l’effet de stabiliser ou soutenir le prix des actions de la Société sur le marché réglementé d’Euronext Paris dans la limite du prix de l’Offre, conformément aux dispositions législatives et réglementaires applicables (notamment celles règlement (UE) no 596/2014 du Parlement européen et du Conseil tel que complété par le Règlement délégué no°2016/1052 de la Commission européenne du 8 mars 2016.
En cas d’exercice de l’Option de Surallocation, cette information sera portée à la connaissance du public au moyen d’un communiqué diffusé par la Société.
- MONTANT BRUT DE L’OPÉRATION
Un montant d’environ 35,0 M€ pouvant être porté à un montant d’environ 40,2 M€ en cas d’exercice intégral de la Clause d’Extension, et à un montant d’environ 46,3 M€ en cas d’exercice intégral de la Clause d’Extension et de l’Option de Surallocation (sur la base du point médian de la fourchette indicative de prix de l’Offre).
- PRODUIT NET DE L’EMISSION
Un montant net d’environ 31,5 M€ pouvant être porté à environ 36,3 M€ en cas d’exercice intégral de la Clause d’Extension et à un montant d’environ 42,0 M€ en cas d’exercice intégral à la fois de la Clause d’Extension et de l’Option de Surallocation (sur la base du point médian de la fourchette indicative de prix de l’offre,).
- STRUCTURE DE L’OFFRE
Il est prévu que l’offre d’actions nouvelles sera réalisée dans le cadre d’une offre globale (l’« Offre »), comprenant :
- Une offre au public en France réalisée sous la forme d’une offre à prix ouvert, principalement destinée aux personnes physiques (l’« Offre à Prix Ouvert » ou « OPO »), étant précisé que :
- les ordres seront décomposés en fonction du nombre de titres demandés : fraction d’ordre A1 (de 1 action jusqu’à 200 actions incluses) et fraction d’ordre A2 (au-delà de 200 actions);
- les fractions d’ordre A1 bénéficieront d’un traitement préférentiel par rapport aux fractions d’ordre A2 dans le cas où tous les ordres ne pourraient pas être entièrement satisfaits.
- Un placement global principalement destiné aux investisseurs institutionnels (le « Placement Global») comportant :
- un placement privé en France ; et
- un placement privé international dans certains pays, en dehors, notamment, des Etats-Unis d’Amérique, du Japon, du Canada et de l’Australie.
Si la demande exprimée dans le cadre de l’OPO le permet, le nombre d’actions allouées en réponse aux ordres émis dans le cadre de l’OPO sera au moins égal à 10% du nombre d’actions offertes dans le cadre de l’offre (avant exercice éventuel de la Clause d’Extension et de l’Option de Surallocation).
- REVOCATION DES ORDRES DE SOUSCRIPTION
Les ordres de souscription passés en ligne dans le cadre de l’Offre à Prix Ouvert seront révocables. Chaque intermédiaire financier détermine les conditions dans lesquelles les ordres transmis peuvent être révoqués. Il appartient donc aux investisseurs désirant révoquer leurs ordres de se rapprocher de leur intermédiaire financier.
Tout ordre placé dans le cadre du Placement Global pourra être révoqué auprès de l’intermédiaire financier ayant reçu cet ordre et ce jusqu’au 3 novembre 2021 à 12 heures (heure de Paris), sauf clôture anticipée ou prorogation du Placement Global.
[1]Ces dispositifs sont conditionnels et dans la limite des plafonds disponibles. Les personnes intéressées sont invitées à se rapprocher de leur conseiller financier.
[2] Sur la base du point médian de la fourchette indicative de prix de l’Offre.
ENGAGEMENTS D’ABSTENTION ET DE CONSERVATION
- Engagement d’abstention de la Société : 180 jours ;
- Engagement de conservation des actionnaires historiques de la Société : 180 jours ;
- Engagement de conservation du management et des salariés : 180 jours ;
ENGAGEMENTS DE SOUSCRIPTION
La Société a reçu des engagements de souscription à hauteur de 17,9 M€ (soit environ 51,2 % du montant de l’Offre initiale sur la base du point médian de la fourchette indicative de prix de l’offre et près de 76 % du montant de l’émission réalisée à hauteur de 75 % du montant de l’Offre initialement prévu sur la base de la borne inférieure de la fourchette indicative de prix de l’offre), à tout prix au sein de la fourchette indicative du Prix de l’Offre, de la part de :
- Seventure Partners, Health for Life Capital pour un montant de 4,9m€ ;
- SymBiosis pour un montant de 4,6m€ ;
- Biocodex pour un montant de 2,3m€ ;
- Bpifrance pour un montant de 2,5m€, via le fonds PSIM ;
- Crédit Mutuel Innovation pour un montant de 3,0m€ ;
- Céleste Management SA for an amount of 0,3m€
- Skyviews Life Science Ltd. 0,4m€ ;
En outre, Eurekare, une société dédiée au financement de sociétés de biotechnologie dans les domaines du microbiote et de la biologie synthétique, s’est par ailleurs engagé à souscrire à l’Offre pour un montant d’1 million d’euros
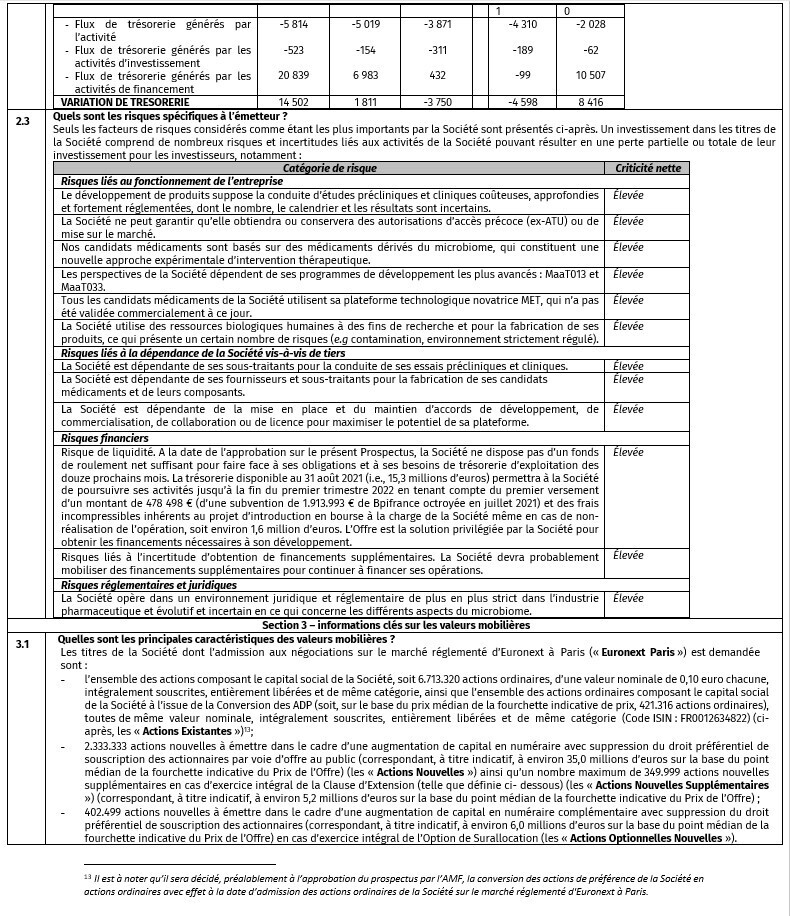
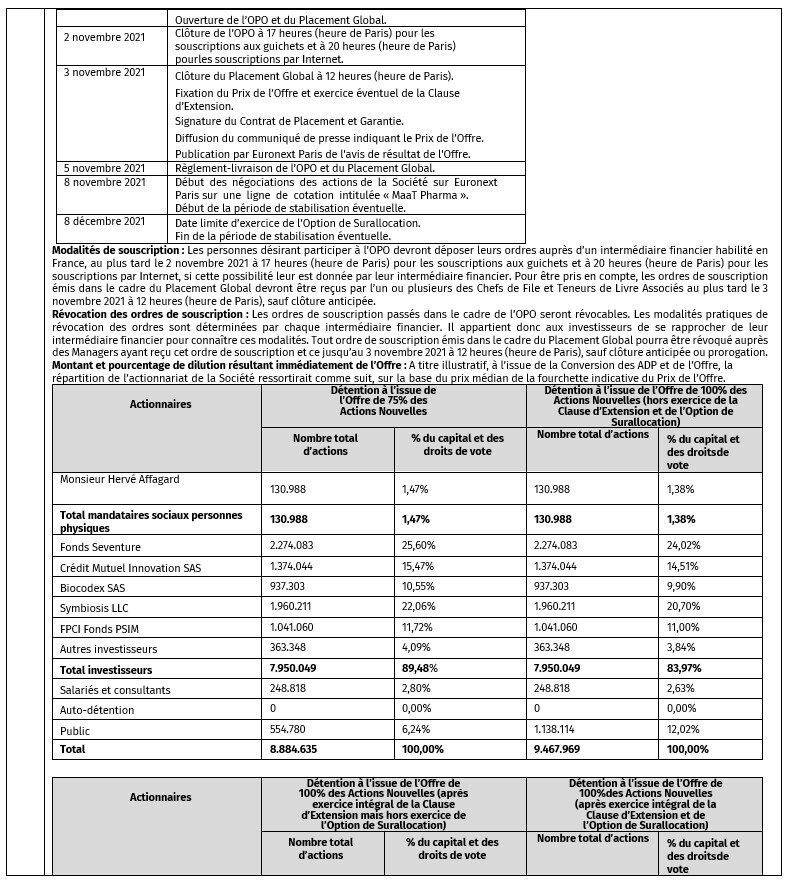
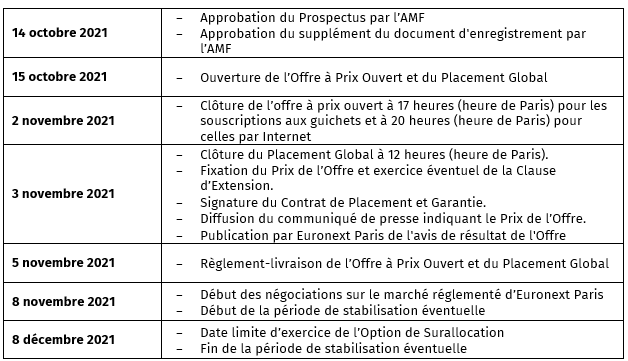
- CALENDRIER INDICATIF
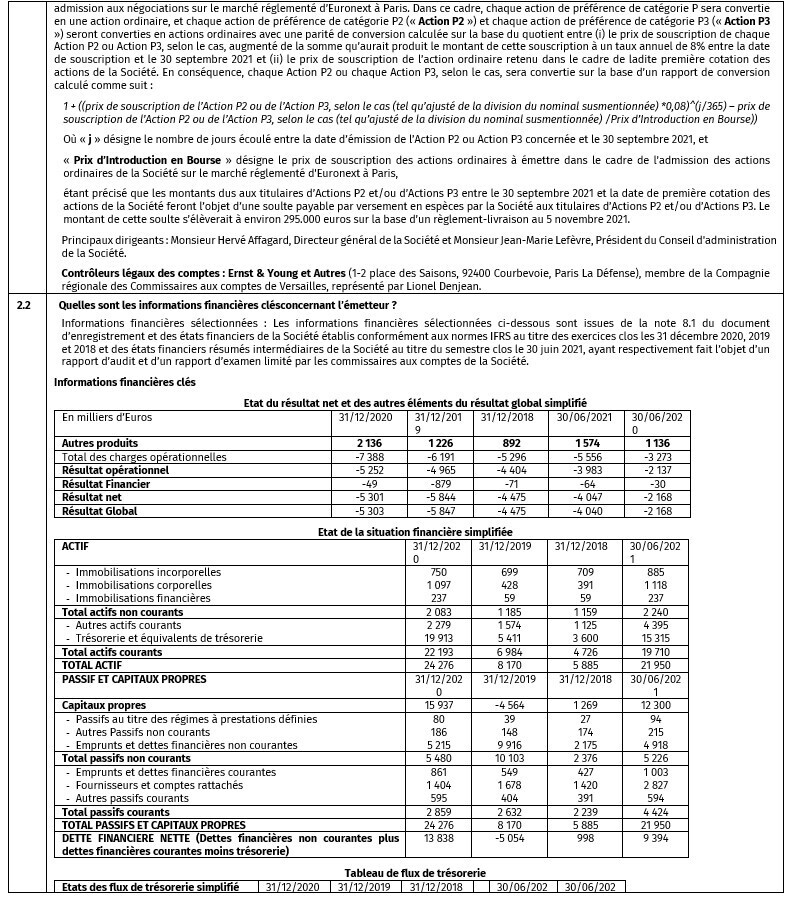
Données prospectives
Ce communiqué de presse contient des déclarations prospectives, notamment des déclarations relatives à la réalisation de l’Offre envisagée et le produit brut attendu de l’Offre. Ces déclarations prospectives peuvent être identifiées par l’utilisation d’une terminologie prospective, dont notamment les mots « penser », « estimer », « anticiper », « prévoir », « envisager », « pouvoir éventuellement », « planifier », « continuer », « continu », « possible », « prédire », « plans », « objectif », « chercher », « devrait », « doit » ou l’emploi du futur ou du conditionnel, et contiennent des énoncés de la Société concernant les résultats envisagés de sa stratégie. Par leur nature, ces déclarations prospectives ne constituent ni des promesses ni des garanties et comportent des risques et des aléas substantiels. Les risques associés aux conditions de marché et autres conditions de financement, les risques associés aux essais cliniques et aux procédures et autorisations réglementaires, et le risque lié à l’insuffisance de trésorerie et de liquidités au sein de la Société constituent autant de facteurs qui pourraient donner lieu à des résultats substantiellement différents de ceux décrits ou anticipés dans les présentes. Une liste détaillée et une description de ces risques, aléas et autres risques figurent dans le document d’enregistrement, le supplément audit document et dans la note d’opération tels qu’approuvés par l’Autorité des Marchés Financiers. Les investisseurs sont avertis qu’ils ne doivent pas se fier indûment à ces déclarations prospectives qui ne valent qu’à la date des présentes. La Société ne prend aucun engagement de mettre à jour ou réviser les déclarations prospectives, que ce soit en conséquence d’une nouvelle information ou d’événements ou circonstances futurs ou autres, sauf dans les cas prescrits par la loi.
Avertissement
Ce communiqué ne peut être distribué directement ou indirectement aux Etats-Unis d’Amérique, au Canada, en Australie, au Japon ou en Afrique du Sud.
La diffusion de ce document peut, dans certains pays, faire l’objet d’une règlementation spécifique ou constituer une violation des dispositions légales en vigueur. Les personnes en possession du présent document doivent s’informer des éventuelles restrictions locales et s’y conformer. Les informations contenues dans le présent communiqué ne constituent pas une offre de valeurs mobilières aux Etats-Unis d’Amérique, au Canada, en Australie, au Japon ou en Afrique du Sud.
Aucune communication, ni aucune information relative à l’émission, l’offre et le placement par la Société de ses actions (les « Actions ») ne peut être diffusée au public dans un pays dans lequel une obligation d’enregistrement ou d’approbation est requise. Aucune démarche n’a été entreprise (ni ne sera entreprise) en dehors de France, dans un quelconque pays dans lequel de telles démarches seraient requises. L’émission ou la souscription des Actions peuvent faire l’objet dans certains pays de restrictions légales ou réglementaires spécifiques. La Société n’assume aucune responsabilité au titre d’une violation par une quelconque personne de ces restrictions.
Le présent communiqué ne constitue pas un prospectus au sens du Règlement (UE) 2017/1129 du Parlement européen et du Conseil du 14 juin 2017, tel que modifié (le « Règlement Prospectus »).
Les présentes informations ne contiennent aucune sollicitation de sommes d’argent, de valeurs mobilières ni d’aucune autre contrepartie et, dans le cas où une contrepartie serait envoyée en réponse aux informations contenues dans les présentes, elle ne serait pas acceptée.
Pour les Etats-Unis et certains autres pays :
Le présent communiqué et les informations qu’il contient, ne constituent ni une offre de vente ou de souscription, ni la sollicitation d’un ordre d’achat ou de souscription, des actions de la Société en Australie, au Canada, au Japon, aux Etats-Unis d’Amérique, en Afrique du Sud, ni dans un quelconque pays. Les actions de la Société ne pourront être offertes ou vendues aux Etats-Unis d’Amérique en l’absence d’enregistrement ou de dispense d’enregistrement au titre du US Securities Act de 1933, tel que modifié. Sous réserve de certaines exceptions, les actions de la Société ne pourront être offertes ou vendues en Australie, au Canada, au Japon, en Afrique du Sud à tout résident ou citoyen d’Australie, du Canada, du Japon ou d’Afrique du Sud. L’offre et la vente des actions de la Société n’ont pas fait l’objet et ne feront pas l’objet d’un enregistrement au titre du US Securities Act de 1933, tel que modifié, ni au titre de toute réglementation applicable en Australie, au Canada, au Japon ou en Afrique du Sud. Il n’y aura pas d’enregistrement de tout ou partie de l’offre mentionnée dans le présent communiqué aux États-Unis d’Amérique ni de réalisation d’une quelconque offre au public portant sur les actions de la Société aux Etats-Unis d’Amérique.
Pour l’Espace Economique Européen :
S’agissant des États membres de l’Espace Economique Européen autres que la France (les « États membres »), aucune action n’a été entreprise et ne sera entreprise à l’effet de permettre une offre au public des titres rendant nécessaire la publication d’un prospectus dans l’un ou l’autre des États membres. En conséquence, les Actions ne peuvent être offertes et ne seront offertes dans les États membres (i) qu’au profit d’investisseurs qualifiés au sens du Règlement Prospectus ou (ii) conformément aux autres dérogations prévues par l’article 1(4) du Règlement Prospectus.
Pour les besoins du présent paragraphe, la notion d’« offre au public d’Actions » dans chacun des États membres se définit comme toute communication adressée sous quelque forme et par quelque moyen que ce soit à des personnes et présentant une information suffisante sur les conditions de l’offre et sur les Actions à offrir, de manière à mettre un investisseur en mesure de décider d’acheter ou souscrire ces Actions.
Cette restriction de placement s’ajoute aux autres restrictions de placement applicables dans les États membres.
Le présent communiqué est une communication à caractère promotionnel et non un prospectus au sens du Règlement (UE) 2017/1129 du Parlement européen et du Conseil européen du 14 juin 2017, concernant le prospectus à publier en cas d’offre au public de valeurs mobilières ou en vue de l’admission de valeurs mobilières à la négociation sur un marché réglementé, et abrogeant la directive 2003/71/CE, tel que modifié (le « Règlement Prospectus »). Toute décision d’acheter ou de souscrire des actions dans le cadre de l’Offre mentionnée dans le présent communiqué ne devra être effectuée que sur la seule base de toutes les informations contenues dans le prospectus approuvé par l’Autorité des marchés financiers (l’« AMF ») le 14 octobre 2021 sous le numéro 21-445 (le « Prospectus ») composé d’un document d’enregistrement enregistré par l’AMF le 1 octobre 2021 sous le numéro I.21-057 et le supplément au document d’enregistrement approuvé par l’AMF le 14 octobre 2021 sous le numéro I.21-061 (le « Document d’Enregistrement »), d’une note d’opération (la « Note d’Opération ») et d’un résumé en français, et publié par la Société dans le cadre de l’offre au public de ses titres, afin de comprendre parfaitement les risques et profits potentiels liés à la décision d’investir dans les valeurs mobilières. Les investisseurs potentiels doivent être en mesure de supporter le risque économique d’un investissement dans les titres de la Société et doivent être capables de supporter une perte partielle ou totale de leur investissement. L’approbation du Prospectus par l’AMF ne doit pas être comprise comme une approbation des titres offerts.
Pour le Royaume-Uni :
Au Royaume-Uni, le présent document ne constitue pas un prospectus approuvé au sens de l’article 85 du Financial Services and Markets Act 2000 tel qu’amendé (le « FSMA »). Il n’a pas été préparé conformément aux Prospectus Rules émises par le UK Financial Conduct Authority (le « FCA ») en application de l’article 73A du FSMA et n’a pas été approuvé ni déposé auprès du FCA ou de toute autre autorité compétente. Les actions nouvelles ou existantes de la Société ne peuvent être offertes ou vendues au public au Royaume-Uni, sauf dans les hypothèses dans lesquelles il serait conforme à la loi de le faire sans mise à la disposition du public d’un prospectus approuvé (au sens de l’article 85 du FSMA) avant que l’offre ne soit réalisée.
Le présent communiqué et les informations qu’il contient s’adressent et sont destinés uniquement aux personnes situées (x) en dehors du Royaume-Uni ou (y) au Royaume-Uni, qui sont des « investisseurs qualifiés » (tel que ce terme est défini dans le Règlement Prospectus qui fait partie du droit interne du Royaume-Uni en application du European Union (Withdrawal) Act 2018) et (i) qui sont des professionnels en matière d’investissements (« investment professionals ») au sens de l’article 19(5) du Financial Services and Markets Act 2000 (Financial Promotion) Order 2005, tel que modifié (le « Financial Promotion Order »), (ii) qui sont visées à l’article 49(2) (a) à (d) du Financial Promotion Order (« high net worth companies, unincorporated associations etc. ») ou (iii) sont des personnes auxquelles une invitation ou une incitation à participer à une activité d’investissement (au sens de l’article 21 du Financial Services and Markets Act 2000) peut être légalement communiquée ou transmise (les personnes mentionnées aux paragraphes (y)(i), (y)(ii) et (y)(iii) étant ensemble dénommées, les « Personnes Habilitées »). Toute invitation, offre ou accord en vue de la souscription ou l’achat de titres financiers objet du présent communiqué est uniquement accessible aux Personnes Habilitées et ne peut être réalisé(e) que par les Personnes Habilitées. Ce communiqué s’adresse uniquement aux Personnes Habilitées et ne peut être utilisé par toute personne autre qu’une Personne Habilitée.
Pour la France :
Des exemplaires du Prospectus sont disponibles, sans frais, auprès de la Société, (adresse du siège social : 70 avenue Tony Garner, 69007, tél. :04 28 29 14 00) ainsi que, sous réserve des limitations habituelles, sur les sites internet de la Société (www.maatpharma.com) et de l’AMF (www.amf-france.org). L’attention du public est attirée sur les facteurs de risques figurant dans le Prospectus et en particulier sur mention des risques les plus importants qui peut être exigée par l’AMF.
Conformément aux exigences en matière de gouvernance des produits prévues par : (a) la Directive 2014/65/UE concernant les marchés d’instruments financiers, telle que modifiée (« MiFID II ») ; (b) les articles 9 et 10 de la directive déléguée (UE) 2017/593 de la Commission complétant la directive MiFID II ; et (c) des mesures de transposition locales (ensemble, les «Exigences en matière de gouvernance»), et déclinant toute responsabilité, découlant de délit, contrat ou autre, que tout « producteur » (au sens des Exigences en matière de gouvernance) pourrait avoir à cet égard, les actions offertes dans le cadre de l’offre (les « Actions Offertes ») ont été soumises à un processus d’approbation à l’issue duquel les Actions Offertes ont été déterminées comme : (i) compatibles avec un marché cible final d’investisseurs de détail et d’investisseurs remplissant les critères des clients professionnels et des contreparties éligibles, tels que définis dans la directive MiFID II ; et (ii) éligibles à la distribution par tous les canaux de distribution, tel qu’autorisé par la directive MiFID II (l’« Evaluation du marché cible »). Nonobstant l’Evaluation du marché cible, les distributeurs doivent noter que : le prix des Actions Offertes peut diminuer et les investisseurs peuvent perdre tout ou partie de leur investissement ; les Actions Offertes ne garantissent aucun revenu ou protection du capital ; et un investissement dans les Actions Offertes n’est approprié que pour les investisseurs qui n’ont pas besoin d’un revenu garanti ou de protection du capital, qui (seuls ou en collaboration avec un conseiller financier ou autre conseil) sont capables d’évaluer le bien-fondé et les risques d’un tel investissement et qui disposent de ressources suffisantes pour pouvoir supporter les pertes qui pourraient en résulter.
L’Evaluation du marché cible est sans préjudice des exigences de restrictions de vente contractuelles, légales ou réglementaires applicables à l’Offre.A toutes fins utiles, l’Evaluation du Marché Cible ne constitue pas : (a) une évaluation pour un client donné de la pertinence ou de l’adéquation aux fins de la directive MiFID II ; ou (b) une recommandation à tout investisseur ou groupe d’investisseurs d’investir, d’acheter ou de prendre toute autre mesure à l’égard des Actions Offertes.
Chaque distributeur est responsable de réaliser sa propre évaluation du marché cible applicable aux Actions Offertes et de déterminer les canaux de distribution appropriés.
Pour éviter toute ambigüité, même si le marché cible inclut les investisseurs de détail, les producteurs et les distributeurs ont décidé qu’ils fourniront uniquement des investisseurs pour les Actions Offertes répondant aux critères d’éligibilité des contreparties éligibles et des clients professionnels.
RESUME DU PROSPECTUS
Approbation AMF n°21- 445 en date du 14 octobre 2021