Restaurer le microbiote en hémato-oncologie :
Les thérapies de MaaT Pharma pour le traitement de la maladie aigüe du greffon contre l’hôte (aGVH) et la prévention des complications de la greffe de cellules souches hématopoïétiques allogéniques (allo-GCSH) ont pour but de restaurer les fonctions physiologiques d’un microbiote sain afin de corriger les effets de facteurs de stress comme les antibiotiques et les chimiothérapies.
Pionniers de l’approche écosystème complet
Nous développons une nouvelle classe de thérapies à base de microbiote,
pour relever le défi d’indications à fort besoin médical en oncologie
Le portefeuille de MaaT Pharma exploite deux approches :
Restaurer et moduler le microbiote en immuno-oncologie :
Les thérapies de MaaT Pharma pour le traitement des tumeurs solides ont pour objectif de restaurer et moduler le microbiote , dans le but d’améliorer la réponse aux inhibiteurs de points de contrôle immunitaires, traitements souvent incontournables dans ces indications.
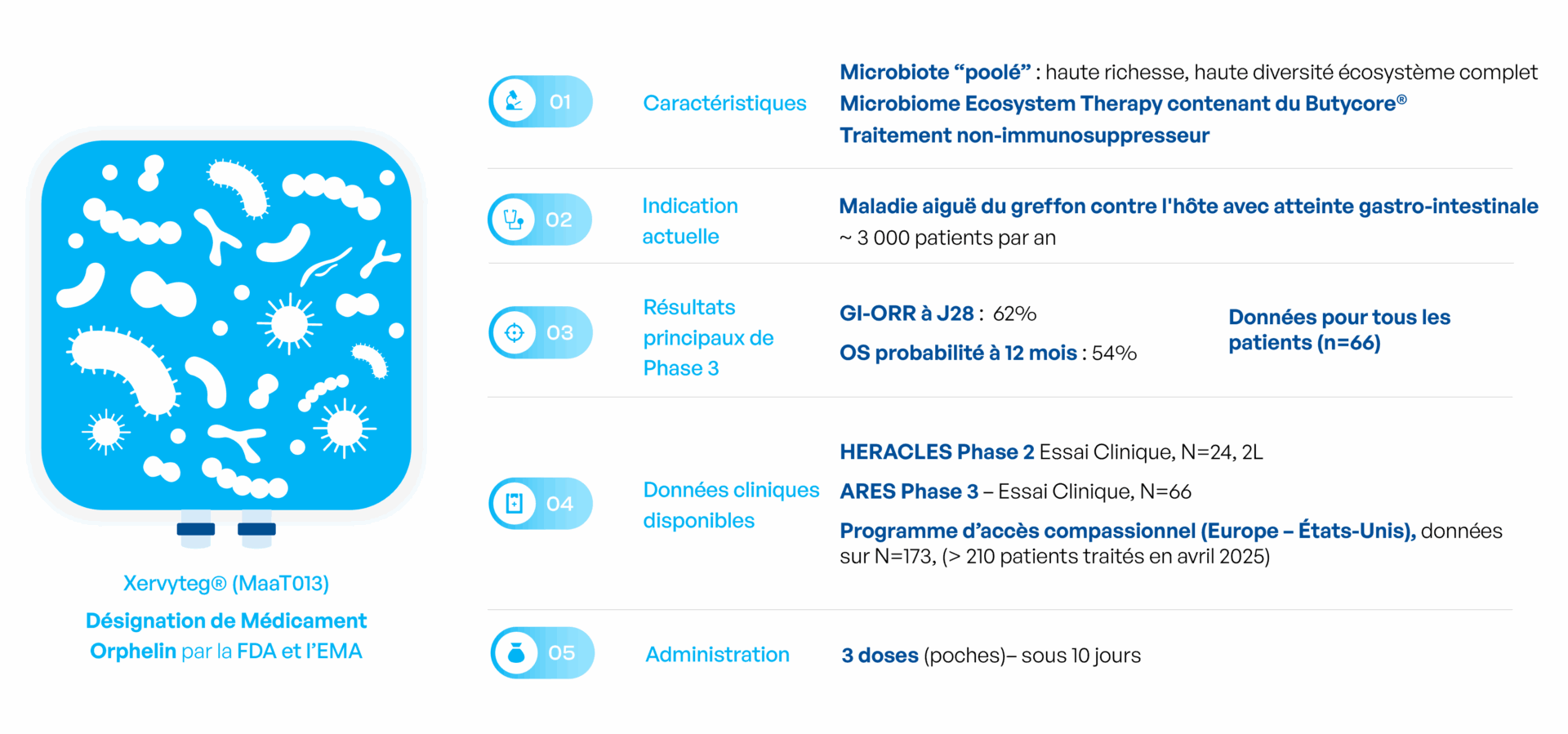
Xervyteg® (MaaT013) : traiter la maladie aigüe du greffon contre l’hôte (aGvH)
50%
70-80%
10 000
Restauration du microbiote avec Xervyteg® (MaaT013) : un produit à densité maximale pour une implantation d’espèces bénéfiques rapide dans les situations d’urgence
Statut de Xervyteg® (MaaT013) : Développement d’une thérapie immunomodulatrice issue du microbiote pour le traitement de la GI-aGvH
Xervyteg® (MaaT013) est un candidat-médicament issu du microbiote actuellement en cours d’examen réglementaire en Europe pour le traitement de la maladie aiguë du greffon contre l’hôte avec atteinte gastro-intestinale (GI-aGvH). Ce traitement a été évalué dans le cadre de l’essai clinique pivotal de Phase 3 ARES (NCT04769895), le premier essai mondial de Phase 3 portant sur une thérapie issue du microbiote en hémato-oncologie.
L’essai ARES a recruté en Europe 66 patients atteints de GI-aGvH réfractaire aux traitements de première ligne par corticoïdes et de deuxième ligne par ruxolitinib, les standards actuels de prise en charge.
300
Étapes cliniques majeures :
– Premier patient traité dans l’essai clinique de Phase 3 ARES
– Avis positif suite à l’évaluation du DSMB* pour l’essai de Phase 3 en cours, confirmant le profil de sécurité
– Résultats principaux positifs de l’étude pivotale de Phase 3 ARES évaluant MaaT013 dans la maladie aiguë du greffon contre l’hôte, montrant une forte efficacité et un profil de sécurité favorable
– Conclusion positive de l’examen final du DSMB pour l’essai clinique pivotal de Phase 3, confirmant un profil bénéfice-risque favorable
– Dossier de demande d’autorisation de mise sur le marché (AMM) soumis à l’Agence européenne des médicaments (EMA) en juin 2025 pour le traitement de la GI-aGvH
*DSMB : Data Safety Monitoring Board, comité indépendant de surveillance des données.
Si approuvé, Xervyteg® (MaaT013) a le potentiel de devenir le premier médicament issu du microbiote approuvé par l’EMA, et le premier au niveau mondial dans une indication en hématologie.
MaaT033 : la capsule de microbiote à écosystème complet, en forme orale, pour des traitements adjuvants
Le besoin médical
La transplantation de cellules souches hématopoïétiques allogéniques (allo-GCSH) est une procédure susceptible de sauver la vie de patients souffrant de cancers du sang comme la leucémie aigüe myéloïde. Malheureusement, elle peut également être associée à des complications graves, comme des infections, la maladie du greffon contre l’hôte, ou la neutropénie, qui contribuent à une mortalité de l’ordre de 34%6, un an après la procédure chez les patients de plus de 50 ans.
20 000
MaaT033 pour améliorer la survie des patients recevant des allo-GSCH
MaaT033 est une thérapie issue du microbiote (MET) sous forme orale, dérivée de donneurs sains, standardisée, à haute richesse et haute diversité bactériennes, qui contient le ButycoreTM, un groupe de bactéries connues pour produire des acides gras à chaîne courte aux propriétés anti-inflammatoires.
- Restauration de la richesse et de la diversité microbiennes et production d’acides gras à chaîne courte immunomodulateurs, qui régulent positivement les cellules TReg, et participent ainsi à la restauration de l’homéostase immunitaires.
- Restauration de la barrière intestinale, qui joue un rôle clé dans la prévention des infections et en particulier celles liées aux bactéries multi-résistantes (MDRB)
Statut de développement de MaaT033
En juin 2022, MaaT Pharma a annoncé des résultats positifs pour MaaT033 dans un essai clinique de Phase 1 (CIMON) auprès de patients atteints de leucémie myéloïde aiguë, à savoir une bonne implantation des espèces bactériennes bénéfiques, qui se maintient dans le temps, associée à un profil de sécurité satisfaisant.
Plus d’informations :
- Clinical trial : NCT04150393
- Communiqué de presse Résultats cliniques CIMON Phase 1b
- Voir le poster détaillant les résultats complets de CIMON présentés à l’ASH 2022
Essai clinique de Phase 2b en cours
En novembre 2023, MaaT Pharma a annoncé le traitement du premier patient dans le cadre de son essai de Phase 2b (PHOEBUS) évaluant l’efficacité de MaaT033 dans l’amélioration de la survie globale à 12 mois pour les patients atteints d’un cancer du sang ayant reçu une allo-GCSH. L’essai, une étude internationale, multicentrique, randomisée, en double aveugle et contrôlée par placebo (NCT05762211), sera mené dans 56 sites d’investigation et devrait inclure 387 patients. Il s’agit, à ce jour, du plus grand essai contrôlé randomisé évaluant une thérapie à base de microbiote en oncologie.
MaaT033 : restaurer la diversité et la richesse du microbiote intestinal chez les patients atteints de SLA
Le besoin médical
Des études récentes mettent de plus en plus en exergue le rôle du microbiote intestinal, en établissant notamment un lien entre des altérations et des maladies telles que la sclérose latérale amyotrophique (SLA[8]). Le lien entre le microbiote intestinal et la SLA a été documenté, dans un premier temps, au travers de données précliniques, puis d’observations cliniques démontrant le rôle modificateur joué par le microbiote intestinal dans la maladie. À ce jour, il n’existe aucun traitement efficace contre la SLA, une maladie qui conduit au décès en moyenne dans les 3 à 5 ans après le diagnostic[9].
Depuis sa création, MaaT Pharma s’est engagée à rétablir la symbiose du microbiote dans les maladies graves avec des besoins médicaux non-satisfaits importants. De plus en plus d’études suggèrent que les patients atteints de SLA présentent une inflammation au niveau de l’intestin et des altérations de la composition des microbes intestinaux, avec des niveaux de bactéries bénéfiques réduits.
60 000
MaaT033 pour ralentir la progression de la maladie de Charcot (SLA)
MaaT Pharma a ainsi décidé d’étendre sa recherche scientifique à la SLA, ce qui pourrait ouvrir la voie pour une approche dédiée pour plusieurs maladies neurodégénératives. La Société s’appuie sur le bon profil de sécurité de ses produits MET natifs (MaaT033/MaaT013), mais également sur les modes d’actions inhérents aux produits, à savoir la modulation immunitaire/les propriétés anti-inflammatoires et leur rôle central pour maintenir l’homéostasie.

- Jusqu’à 15 patients dans une étude pilote ouverte de Phase 1b en France
- Objectifs clés de l’étude : évaluer la sécurité et la tolérabilité de MaaT033 ainsi que l’évolution de la composition du microbiote intestinal

Sources
1 Castilla-Llorente. C, et al. Prognostic factors and outcomes of severe gastrointestinal GVHD after allogeneic hematopoietic cell transplantation. Bone Marrow Transplant. 2014 49(7):966-71. doi:10.1038/bmt.2014.69
2 Peled JU, et al. Role of the intestinal mucosa in acute gastrointestinal GVHD. Blood. 2016 128(20):2395-2402. doi: 10.1182/blood-2016-06-716738.
Staffas A, et al. The intestinal microbiota in allogeneic hematopoietic cell transplant and graft-versus-host disease. Blood. 2017 129(8):927-933. doi: 10.1182/blood-2016-09-691394. Erratum in: Blood. 2017 Apr 13;129(15):2204
Mathewson ND, et al. Gut microbiome-derived metabolites modulate intestinal epithelial cell damage and mitigate graft-versus-host disease. Nat Immunol. 2016 505-513. doi: 10.1038/ni.3400. Epub 2016 Mar 21. Erratum in: Nat Immunol. 2016 Sep 20;17 (10 ):1235.
3 Taur Y, et al. The effects of intestinal tract bacterial diversity on mortality following allogeneic hematopoietic stem cell transplantation. Blood. 2014 124(7):1174-82. doi:10.1182/blood-2014-02-554725.
Jenq RR, et al. Regulation of intestinal inflammation by microbiota following allogeneic bone marrow transplantation. J Exp Med. 2012 903-11. doi: 10.1084/jem.20112408.
4 Jenq RR, et al. Intestinal Blautia Is Associated with Reduced Death from Graft-versus-Host Disease. Biol Blood Marrow Transplant. 2015 1373-83. doi:10.1016/j.bbmt.2015.04.016.
Peled JU, et al. Intestinal Microbiota and Relapse After Hematopoietic-Cell Transplantation. J Clin Oncol. 2017 1650-1659. doi:10.1200/JCO.2016.70.3348
5 Global Data GVHD Epidemiology Report, Jan 2020.
6 EBMT data 2021
7 Malard, F., Vekhoff, A., Lapusan, S. et al. Gut microbiota diversity after autologous fecal microbiota transfer in acute myeloid leukemia patients. Nat Commun 12, 3084 (2021). https://doi.org/10.1038/s41467-021-23376-6
[8] Rowin et al., 2017; Nicholson et al, 2021; Blacher et al, 2019, Mazzini et al, 2020
[9] https://tousensellescontrelasla.fr/la-sla-cest-quoi/
MaaT03X pour améliorer les traitements contre les cancers
Le besoin médical
Les Inhibiteurs de points de Contrôle Immunitaires (ICI) se sont établis comme une option thérapeutique de choix pour le traitement des tumeurs solides. Ils ont notamment amélioré les chances de survie des patients dans plus d’une quinzaine d’indications à ce jour. Cependant, certains patients ne répondent pas au traitement par ICIs. Dans certaines indications, il a été suggéré que le microbiote intestinal pourrait jouer un rôle dans la réponse aux ICI.
80%
MaaT034 – une thérapie issue de microbiote synthétique innovant, indépendant des donneurs et doté d’un écosystème complet, pour optimiser le traitement par inhibiteurs de points de contrôle immunitaire (ICI).
MaaT034, produit de co-culture « first-in-class », vise à optimiser les fonctions du microbiome intestinal avant et pendant l’immunothérapie dans les principales indications oncologiques, et à devenir une thérapie (néo)-adjuvante à travers les thérapies ICI, conduisant à une meilleure survie chez les patients atteints de cancer. L’objectif de MaaT Pharma est de développer MaaT034 en tant que thérapie en combinaison avec les ICI (c.-à-d. administration avant et en combinaison avec les ICI quel que soit le type de cancer) conduisant à de meilleurs résultats cliniques et à une incidence plus faible de complications que l’utilisation des ICI seuls.
Pour y parvenir, MaaT Pharma capitalisera sur les produits MET-N : un essai promu par les investigateurs est déjà en cours dans les tumeurs solides avec l’essai PICASSO (mélanome métastatique, avec Xervyteg® – MaaT013) pour évaluer la sécurité des produits MET-N en combinaison avec l’ICI et recueillir des données préliminaires d’efficacité évaluant l’impact des produits MET sur le système immunitaire et les réponses anti-tumorales.
Statut de développement de MaaT034
MaaT034 est actuellement en développement préclinique.
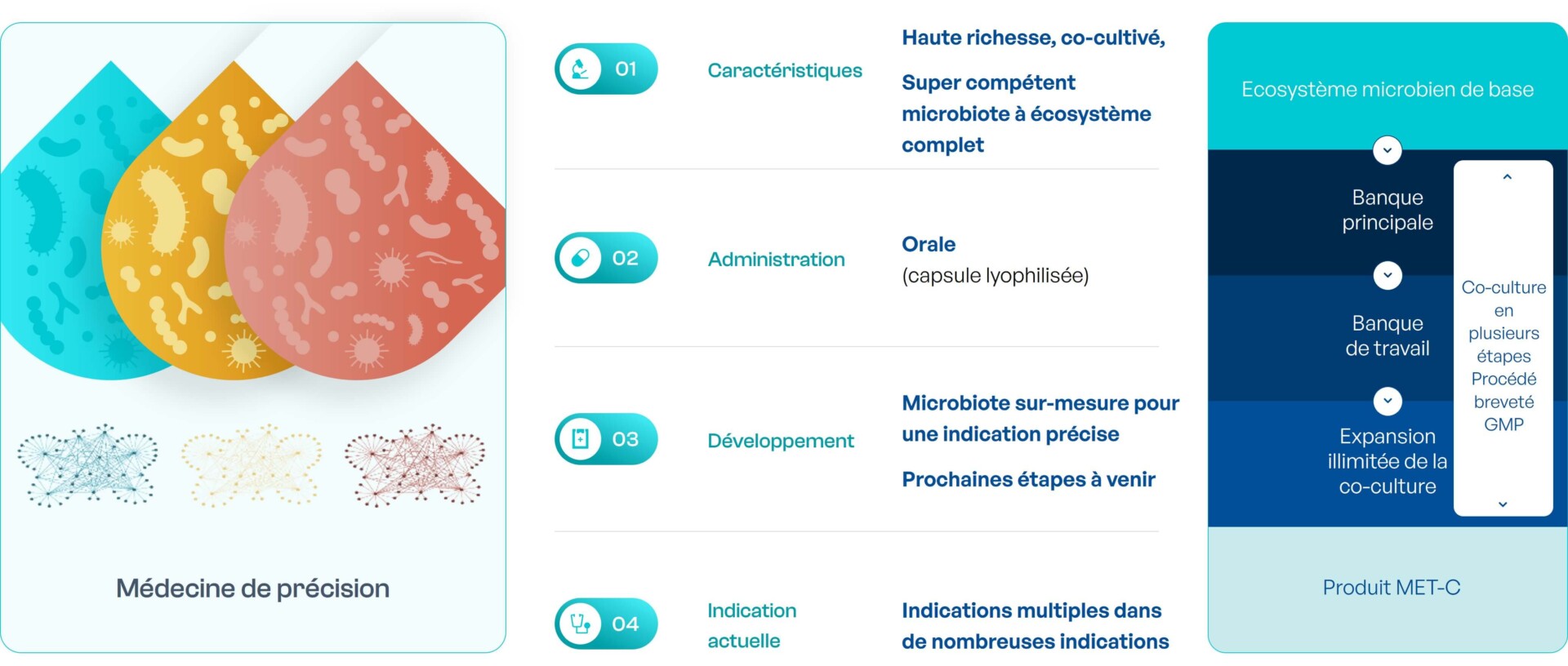
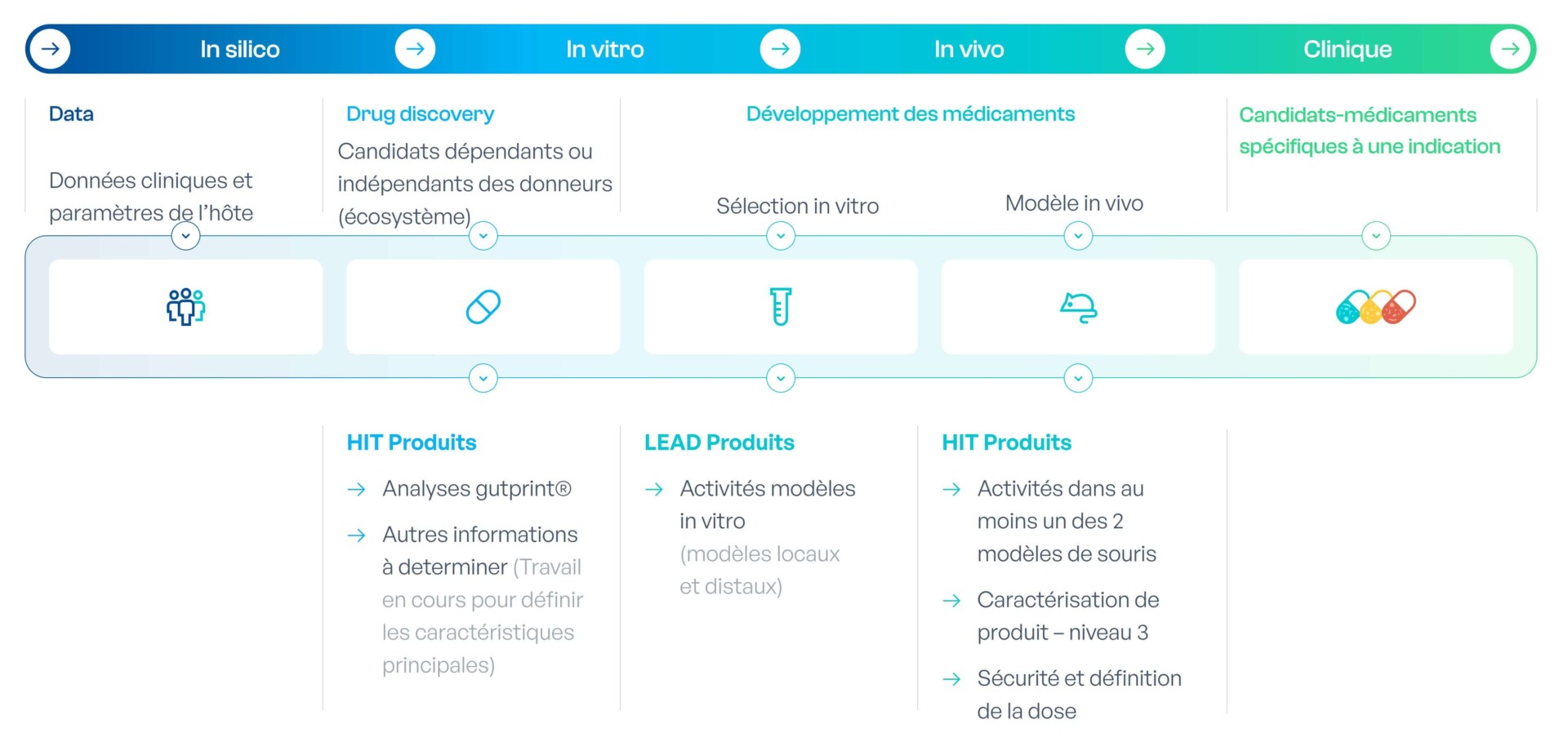
MaaT03X : thérapies issues de microbiotes synthétiques super-compétents produites sur-mesure via IA et spécifiques à une indication
MaaT03X est une thérapie issue de microbiote à écosystème complet super-compétent développée par co-culture adapté à des indications spécifiques. Grâce à la collecte de données auprès de patients, de donneurs sains et de la littérature, ainsi que de données recueillies au cours du développement de MaaT034 (échantillons fécaux et biologiques), MaaT Pharma alimente continuellement la plateforme d’IA gutPrint, pour développer des médicaments-microbiote de nouvelle génération
Publications scientifiques
Articles dans des Revues à Comité de Lecture
- Malard F. et al. (2018). High gastrointestinal microbial diversity and clinical outcome in graft-versus-host disease patients. Bone Marrow Transplantation.
- Malard F. et al. (2021). Restoration of gut microbiota diversity with autologous fecal microbiota transfer in acute myeloid leukemia patients. Nature communications.
- Malard F et al. (2023). Pooled allogeneic faecal microbiota MaaT013 for steroid-resistant gastrointestinal acute graft-versus-host disease: a single-arm, multicentre phase 2 trial. eClinicalMedicine
- Biennier S. et al (2024). Narrative Review: Advancing Dysbiosis Treatment in Onco-Hematology with Microbiome-Based Therapeutic Approach. Microorganisms
- Laperrousaz B. et al (2024). Safety comparison of single-donor and pooled fecal microbiota transfer product preparation in ulcerative colitis: systematic review and meta-analysis. BMC Gastroenterology
Communications « Posters » lors de congrès majeurs
- Malard F. et al. (2024). MaaT033 pour assurer un microbiote intestinal optimal afin d’améliorer la survie des patients recevant une allo-CSH : Essai PHOEBUS. SFGM-TC Congress (French only)
- Malard F. et al. (2024). PHOEBUS Trial: an international, randomized, double-blind, multicenter phase IIb study evaluating MaaT033, oral allogeic fecal microbiotherapy, in patients undergoing allo-HSCT to improve overall survival. SEHH Congress (Spanish only)
- Malard F. et al. (2022). Pooled allogenic fecal microbiotherapy MaaT013 for the treatment of steroid-refractory gastrointestinal acute graft versus-host disease: results from the phase IIa HERACLES study and expanded access program. IHMC congress
- Gasc C. et al. (2022). Pooling of faecal material results in standardized and high-richness microbiotherapy products MaaT013 and MaaT033. IHMC congress
- Duquenoy A.et al. (2022).Development of a culture manufacturing process preserving the profile of gut microbiota for therapeutic purposes. IHMC congress
- Malard F. et al. (2019). Successful and safe treatment of intestinal Graft-versus-Host Disease (GvHD) with pooled-donor full ecosystem microbiota biotherapeutics. Blood. ASH congress
- Malard F. et al. (2019). Heracles: a phase II single-arm prospective study to assess the efficacy of fecal microbiota transfer (FMT) in the treatment of steroid-refractory gastro-intestinal predominant aGVHD post allo-HSCT. EBMT congress
- Mohty M. et al. (2018). The Odyssee Study: Prevention of Dysbiosis Complications with Autologous Fecal Microbiota Transfer (FMT) in Acute Myeloid Leukemia (AML) Patients Undergoing Intensive Treatment: Results of a Prospective Multicenter Trial. Blood. ASH congress
- Mohty M. et al. (2017). Prevention of dysbiosis complications with autologous fecal microbiota transplantation (auto-FMT) in acute myeloid leukemia (AML) patients undergoing intensive treatment (ODYSSEE study): first results of a prospective multicenter trial. Blood. ASH congress
Communications orales lors de Congrès majeurs
- Malard F. et al. (2024). Pooled fecal allogenic microbiotherapy for refractory gastrointestinal acute graft-versus-host disease: results from the early access program in Europe. SFGM-TC Congress
- Sanz J. (2024) Allogenic fecal microbiotherapy as a treatment for refractory Graft-versus-Host acute gastrointestinal disease: results of the EAP in Europe. SEHH Congress
- Malard F. et al. (2021). 262 Pooled Allogenic Fecal Microbiotherapy MaaT013 for the Treatment of Steroid-Refractory Gastrointestinal Acute Graft-Versus-Host Disease: Results from the Phase IIa Heracles Study and Expanded Access Program. ASH congress
- Malard F. et al. (2021). Successful and Safe Treatment of Intestinal Graft-Versus-Host Disease (GvHD) with Pooled-Donor Full Ecosystem Microbiota Biotherapeutic: Results from a 29 Patient-Cohort of a Compassionate Use/Expanded Access Treatment Program. EBMT congress
- Malard F. et al. (2020). Successful and Safe Treatment of Intestinal Graft-Versus-Host Disease (GvHD) with Pooled-Donor Full Ecosystem Microbiota Biotherapeutic: Results from a 29 Patient-Cohort of a Compassionate Use/Expanded Access Treatment Program. Blood. ASH congress
- Malard F. et al. (2020). Successful and safe treatment of intestinal graft-versus-host disease (GvHD) with pooled-donor full ecosystem microbiota biotherapeutics. EBMT congress
- Malard F. et al. (2019). The odyssee study: prevention of dysbiosis complications with autologous fecal microbiota transfer in acute myeloid leukemia patients undergoing intensive-treatment: results of a prospective multicenter trial. EBMT congress